Όψιμη εκδήλωση μυοκαρδίτιδας στα πλαίσια Πολυσυστηματικού Φλεγμονώδους
Συνδρόμου μετά από λοίμωξη COVID-19: Η θέση της καρδιαγγειακής απεικόνισης στην μυοκαρδίτιδα
Delayed-onset myocarditis as a part of Multisystem Inflammatory Syndrome post
COVID-19: Multimodality imaging in the clinical scenario of myocarditis
Συγγραφείς:Καμπερίδης Βασίλειος MD , MSc, PhD, FESC , Καρδιολόγος , Ακαδημαϊκός Υπότροφος ΑΠΘ, 1 η Καρδιολογική Κλινική, Νοσοκομείο ΑΧΕΠΑ, Θεσσαλονίκη,
Τζιάτζιος Γεώργιος , MD, MSc, Καρδιολόγος, 1 η Καρδιολογική Κλινική, Νοσοκομείο ΑΧΕΠΑ, Θεσσαλονίκη,
Κούσκουρας Κωνσταντίνος MD, PhD ,Επίκουρος Καθηγητής A κτινολογίας, Εργαστήριο Ακτινοδιαγνωστικής ΑΠΘ, Νοσοκομείο ΑΧΕΠΑ,
Θεσσαλονίκη
Κοκκάλη Ελένη MD ,Διευθύντρια ΕΣΥ, Καρδιολόγος, Γ.Ν.Θ. «Γ. Γεννηματάς», Θεσσαλονίκη
Καραμήτσος Θεόδωρος , MD, Αναπληρωτής Καθηγητής Καρδιολογίας ΑΠΘ, 1η Καρδιολογική Κλινική, Νοσοκομείο ΑΧΕΠΑ, Θεσσαλονίκη
Παρουσίαση περιστατικού
Ασθενής 19 ετών, αρχικά νοσηλευόμενος στην Παθολογική Κλινική λόγω εμπυρέτου(θ >40 oC) από πενθημέρου και συνοδού φαρυγγαλγίας, υποτροπιάζοντος κοιλιακού άλγους, εξανθήματος άνω άκρων και αισθήματος παλμών διεκομίσθη στην Καρδιολογική Κλινική ως πιθανή περιμυοκαρδίτιδα.
Αρχική Εικόνα
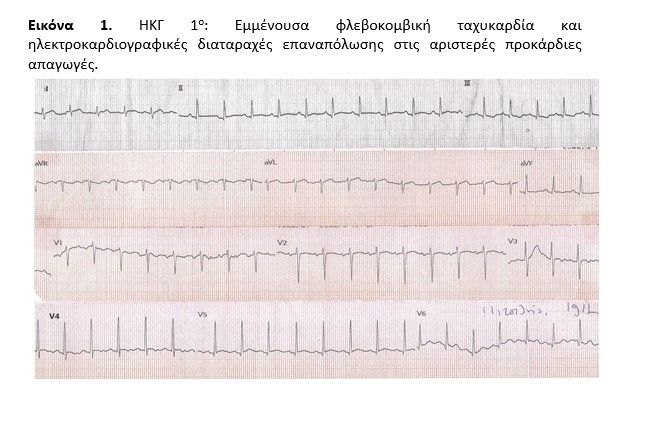
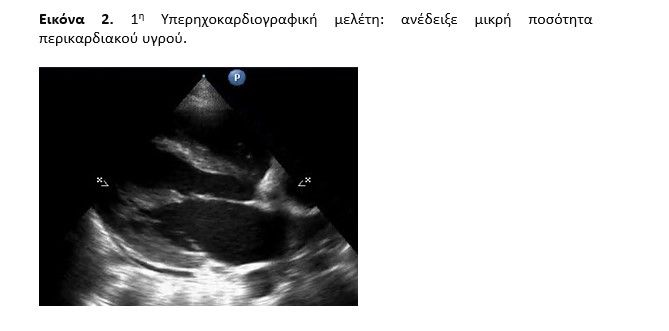
Η κλινική υποψία οξείας μυοκαρδίτιδας ετέθη καθώς ο ασθενής παρουσίασε εμμένουσα φλεβοκομβική ταχυκαρδία και ηλεκτροκαρδιογραφικές διαταραχές επαναπόλωσης (εικόνα 1) στις αριστερές προκάρδιες απαγωγές με συνοδό κινητοποίηση μυοκαρδιακών ενζύμων (hs.trop: 770 pg/ml). Διενεργήθηκε άμεσα διαθωρακική υπερηχοκαρδιογραφική μελέτη με ανάδειξη μικρής ποσότητας περικαρδιακού υγρού (εικόνα 2) χωρίς λοιπή σημειολογία και ακολούθως μεταφέρθηκε στην Καρδιολογική Κλινική (σε μονόκλινο θάλαμο νοσηλείας) υπό συνεχές monitoring, ως πιθανή οξεία περιμυοκαρδίτιδα. Αξίζει να σημειωθεί ότι πλην της φαρυγγαλγίας και της έντονης καταβολής ο ασθενής δεν ανέφερε θωρακικό άλγος τόσο κατά την προσέλευση όσο και στη συνέχεια, παρά μόνον άτυπο οπισθοστερνικό, αρχόμενο αμέσως μετά από επεισόδια εμέτου κατά τη διάρκεια των πυρετικών αιχμών ενώ παρουσίασε και υποτροπιάζον κοιλιακό άλγος χωρίς αντικειμενικά ευρήματα κατά τη χειρουργική εκτίμηση.
• Ατομικό ιστορικό: Λοίμωξη Sars-Cov2 προ 6 εβδομάδων, ερασιτέχνης αθλητής
• Ζωτικά σημεία: ΑΠ: 100/50 mmhg, Σφ: 115 bpm, θ: 38.9 oC, SpO2: 97%
• Κλινική εξέταση: Όψη πάσχοντoς, κηλιδοβλατιδώδες εξάνθημα άνω άκρων αμφω, Α.Ψ: κφ, παρίσθμια: εξέρυρθρα – διογκωμένοι ψηλαφητοί τραχηλικοί λεμφαδένες, κοιλία: μαλακή, ευπίεστη αλλά με αναφορά υποτροπιάζοντος έντονου διάχυτου κοιλιακού άλγους, S1-S2: ταχείς, ρυθμικοί, χωρίς ήχο τριβής, σφυγμοί: συμμετρικοί, ψηλαφητοί άμφω, απουσία περιφερικού οιδήματος.
• Εργαστηριακός έλεγχος: Θετική κίνηση μυοκαρδιακών ενζύμων (Peak.hs.trop: 770pg/ml, CK: 771 U/L, CK-MB: 80 U/L), πτώση των σειρών του περιφερικού αίματος συγκριτικά με την ημέρα έναρξης του εμπυρέτου (λευκοπενία, λεμφοπενία αναιμία, θρομβοπενία, WBC: 8.5 -> 3.4× 109/L, Hct: 45% -> 34.9%, PLT: 300×103/μL -> 120×103/μL), υψηλοί δείκτες φλεγμονής (CRP: 23 mg/dl, TKE: 53 mm/h, Interleukin-6: 160pg/ml, Peak D-Dimer: 6.86 ug/ml). PCR Sars-Cov2: (-), Sars-Cov2.IgG.Ab: 6.06(+)(URL: 1.4 S/co), Sars-Cov2.IgM.Ab: 1.26 (URL: 1.0 S/co).
• Απεικονιστικός έλεγχος: Ro θώρακος: κφ, u/s τραχήλου: τραχηλική λεμφα- δενοπάθεια, u/s άνω κοιλίας: ήπια σπληνομεγαλία, ελεύθερη ποσότητα υγρού στην ελάσσονα πύελο, παρακολικά άμφω, παρατυφλικά και ελάχιστη ποσότητα υφηπατικά, παρουσία οριακά διογκωμένων μεσεντέριων και βουβωνικών λεμφαδένων.
• Φαρμακευτική αγωγή: Κλαριθρομυκίνη iv 500mg 1×2.
Πορεία νόσου
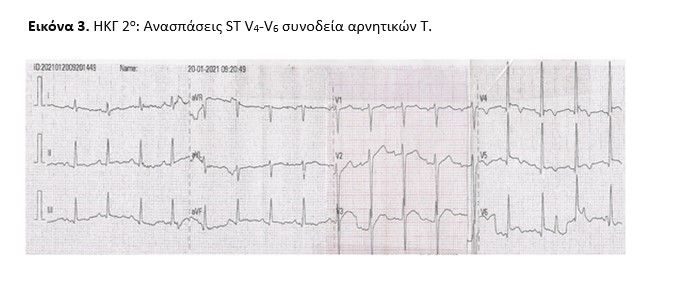
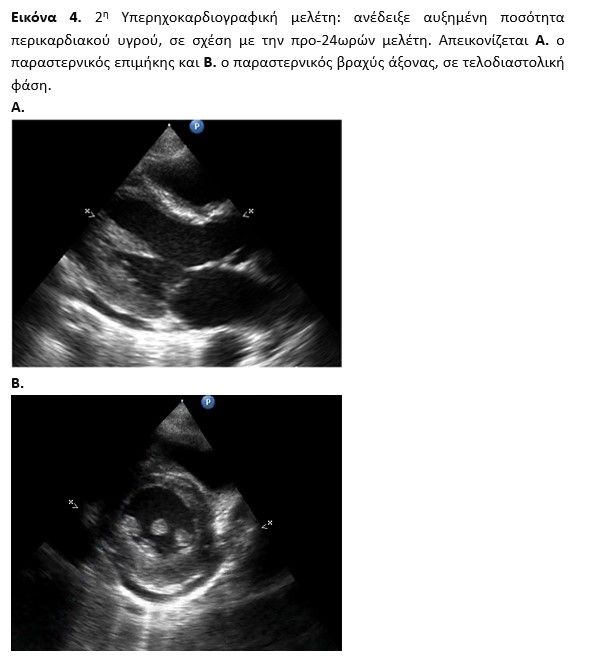
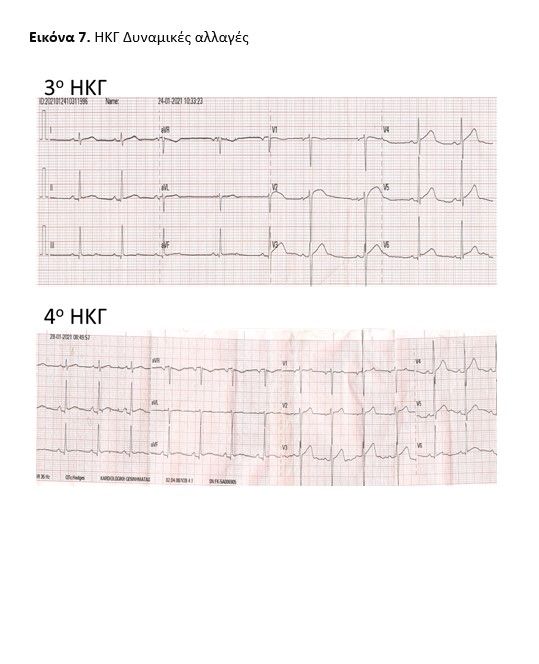
Ο ασθενής επανεκτίμηθηκε με 2η υπερηχογραφική μελέτη σε 48h καθώς παρουσίασε δυναμικές ηλεκτροκαρδιογραφικές αλλαγές (ανασπάσεις ST V4-V6 συνοδεία αρνητικών Τ) (εικόνα 3) και ένα βραχύ αυτοαναταχθέν επεισόδιο υπερκοιλιακής ταχυκαρδίας. Διαπιστώθηκαν τμηματικές τοιχωματικές υποκινησίες (υποκινησία βασικού προσθίου διαφραγματικού, βασικού κατωτέρου διαφραγματικού και βασικού κατωτέρου τοιχώματος) και ήπια αυξημένο πάχος τοιχωμάτων ενώ το περικαρδιακό υγρό αυξήθηκε οριακά (εικόνα 4, video ECHO 2nd).
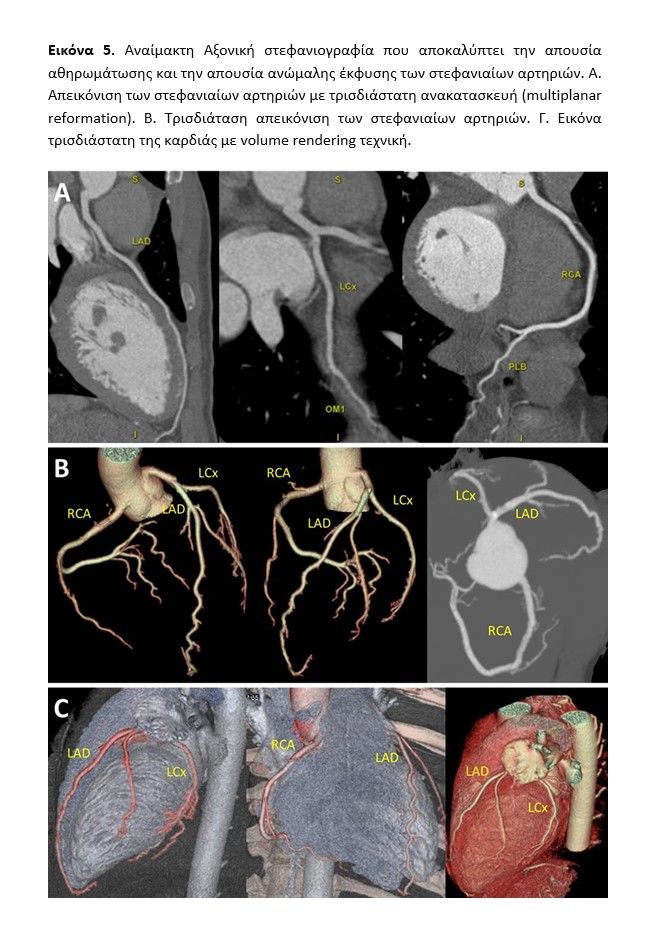
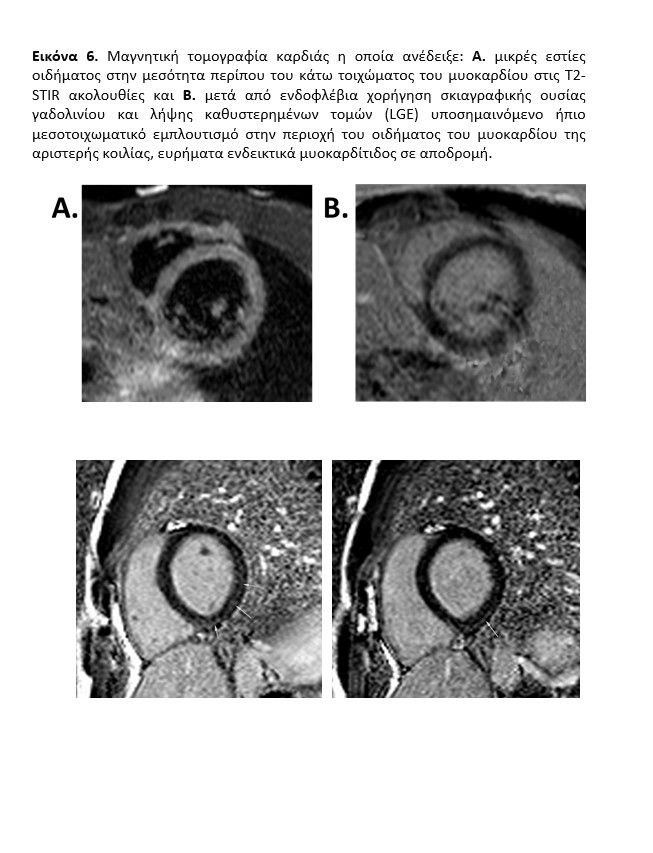
Αντί κλασικής διαδερμικής στεφανιογραφίας ακολούθησε διενέργεια αξονικής στεφανιογραφίας (εικόνα 5) προς αποκλεισμό οξέος στεφανιαίου συνδρόμου σε ενδεχόμενο υπόβαθρο αθηρωματικής νόσου ή θρόμβωσης ή διαχωρισμού στεφανιαίας αρτηρίας ή σημαντικής μυοακρδιακής γέφυρας ή συγγενούς ανωμαλίας στεφανιαίων αγγείων ενώ ταυτόχρονα απεικονίσθηκε και ο υπόλοιπος θώρακας και το πνευμονικό παρέγχχυμα με ανάδειξη ικανών υπεζοκωτικών συλλογών με συνοδές ατελεκτασίες καθώς και μικρής έκτασης περιοχές ‘’θολής υάλου’’ στους κάτω λοβούς του πνευμονα, ιδίως αριστερά. Στη συνέχεια υπεβλήθη σε μαγνητική τομογραφία καρδιάς (εικόνα 6, video Cardiac MRI inpatient) η οποία ανέδειξε μικρές εστίες οιδήματος στην μεσότητα περίπου του κάτω τοιχώματος του μυοκαρδίου στις T2-STIR ακολουθίες και μετά από ενδοφλέβια χορήγηση σκιαγραφικής ουσίας γαδολινίου και λήψης καθυστερημένων τομών (LGE), υποσημαινόμενο ήπιο μεσοτοιχωματικό εμπλουτισμό στην περιοχή του οιδήματος του μυοκαρδίου της αριστερής κοιλίας, ευρήματα ενδεικτικά μυοκαρδίτιδος σε αποδρομή. Ο ασθενής ετέθη σε αγωγή ιβουπροφαίνης (600mg 1×2), μικρή δόση β-
αποκλειστή (μετοπρολόλη 100mg 1/4×2), α-ΜΕΑ (ραμιπρίλη 2.5 1×1) – μόλις το επέτρεψε η αρτηριακή πίεση – και ηπαρίνη χαμηλού μοριακού βάρους.

Εστάλη πλήρης ιολογικός έλεγχος (Toxo, CMV, EBV, HAV, HBV, HCV, HIV, HSV, Echovirus, ParvoB19, Coxsackie, Μycoplasma, Legionella, Mantoux, ASTO, Widal, Wright) ο οποίος απέβη αρνητικός, ελήφθησαν νέες καλλιέργειες αίματος (επίσης όλες αρνητικές) και πολλαπλές επαναληπτικές PCR Sars-Cov2: (-). Έγινε κλιμάκωση της αντιβιοτικής αγωγής και ο ασθενής αφού συνέχισε να παρουσιάζει πολλαπλά υψηλά πυρετικά κύματα έως την 5η ημέρα νοσηλείας, σταδιακά μειώθηκαν σε συχνότητα, απυρετώντας πλήρως την 8η ημέρα νοσηλείας. Οι δείκτες φλεγμονής και τα μυοκαρδιακά ένζυμα παρουσίασαν πτωτική πορεία, οι αιματολογικές σειρές ανέκαμψαν βαθμιαία στα φυσιολογικά επίπεδα και το ηλεκτροκαρδιογράφημα αφού παρουσίασε δυναμικές αλλαγές (εικόνα 7 ) εν τέλει φυσιολογικοποιήθηκε.
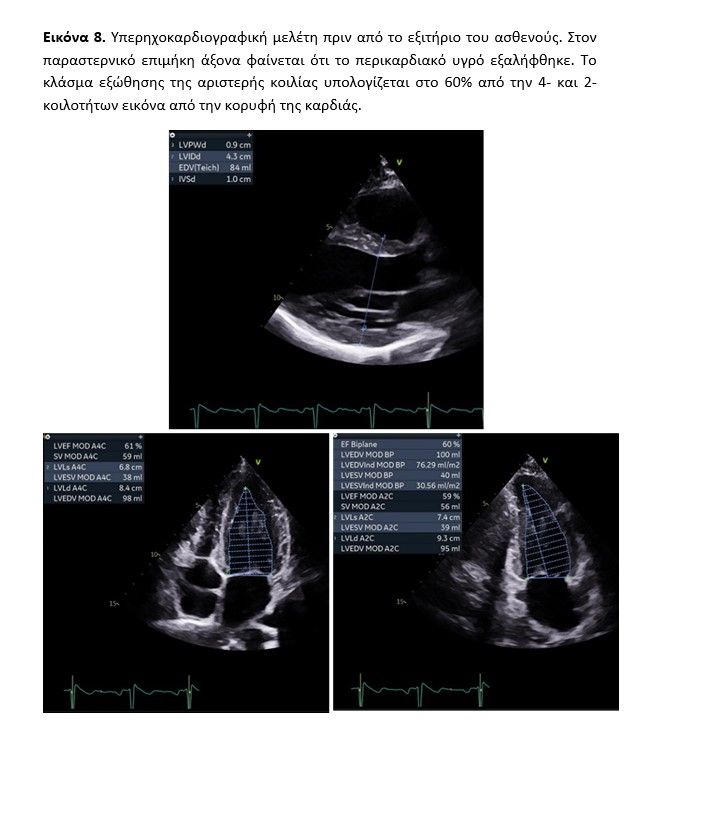
Η 3η και 4η (προ του εξιτηρίου) κατά σειρά υπερηχογραφική μελέτη (εικόνα 8, video echo pre-discharge) ανέδειξαν εμφανή μείωση – έως εξαφάνιση – της περικαρδιακής συλλογής αλλά με παραμένουσες τις τοιχωματικές τμηματικές υποκινησίες και διατήρηση ικανοποιητικής συνολικής συστολικής λειτουργίας (EF: 60%). Ταυτόχρονα εκτιμήθηκε η συνολική και τμηματική μυοκαρδιακή παραμόρφωση (εικόνα 9) η οποία ανευρέθη συνολικά μειωμένη (GLS: -17,7%).

Ο ασθενής εξήλθε ασυμπτωματικός, απύρετος με οδηγίες εργαστηριακής – υπερηχογραφικής επανεκτίμησης και – βάσει των αποτελεσμάτων – σταδιακής αποκλιμάκωσης της φαρμακευτικής αγωγής. Παράλληλα συνεστήθη αποχή από την άθληση και προγραμματίστηκε πλήρης επανεκτίμηση (εργαστηριακός και
υπερηχοκαρδιογραφικός έλεγχος, δοκιμασία κόπωσης, holter ρυθμού, επαναληπτική μαγνητική τομογραφία καρδιάς) σε 3 μήνες προς καθορισμό της δυνατότητας επιστροφής σε αθλητικές δραστηριότητες.
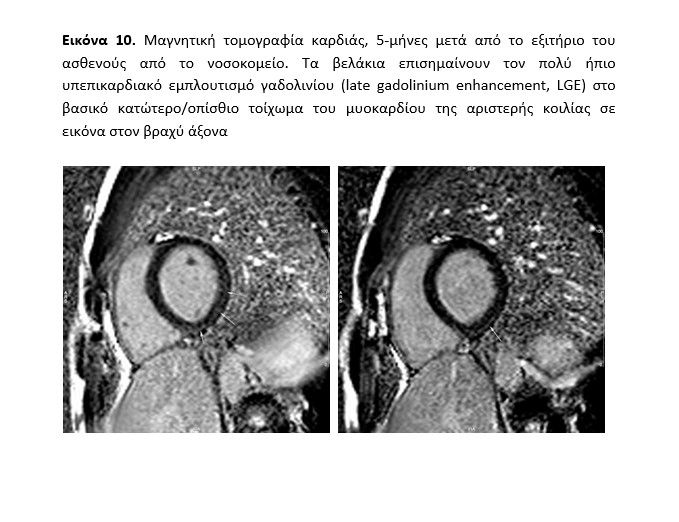
Ο ασθενής επανήλθε για έλεγχο στους 5 μήνες: ο αιματολογικός έλεγχος, ο υπερηχοκαρδιογραφικός έλεγχος, το τεστ κόπωσης και το Holter ρυθμού ήταν απολύτως φυσιολογικά. Η μαγνητική τομογραφία καρδιάς ανέδειξε πολύ ήπιο υπεπικαρδιακό εμπλουτισμό γαδολινίου (late gadolinium enhancement, LGE) στο βασικό κατώτερο/οπίσθιο τοίχωμα του μυοκαρδίου της αριστερής κοιλίας (εικόνα 10, video Cardiac MRI follow-up). Με τις παραπάνω εξετάσεις αποκλείσθηκε η ενεργός φλεγμονή, εγινε διακοπή της πολύ μικρής ποσότητας αMEA και του β-blocker που λάμβανε και συνεστήθει επανέναρξη της αθλητικής δραστηριότητας.
Συζήτηση
Η μυοκαρδιακή προσβολή στο περιγραφόμενο κλινικό σενάριο αποτελεί πιθανώς επιμέρους εκδήλωση γενικότερης πολυσυστηματικής φλεγμονώδους αντίδρασης (Multisystem Inflammatory Syndrome, MIS), μίας σπάνιας αλλά σοβαρής όψιμης επιπλοκής σε ασθενείς με αποδραμούσα ή προσφάτως παρελθούσα λοίμωξη από SARS-CoV-2. Σύμφωνα με τα λιγοστά προσφάτως δημοσιευμένα διεθνή βιβλιογραφικά δεδομένα παρουσιάζεται συχνότερα σε παιδιά και εφήβους (MIS-C) [1][2][3][4] αλλά έχει αναφερθεί και σε ενήλικες (MIS-A) [5][6][7] με παρόμοιες εκδηλώσεις. Κάτα τη
διάρκεια της πανδημίας COVID-19 έχουν περιγραφεί αυξανόμενες αναφορές περιστατικών του νέου αυτού πολυσυστηματικού φλεγμονώδους συνδρόμου σε ασθενείς με πρόσφατη λοίμωξη SARS-CoV-2 καταλήγοντας στη συγκεκριμένη κλινική διάγνωση [6] εφόσον συμπεριλαμβάνεται η πλειοψηφία των ακολούθων κλινικο-εργαστηριακών χαρακτηριστικών, την οποία συγκεντρώνει και το παρόν περιστατικό:
Κλινικά, εμφανίζεται οξέως εντός μερικών εβδομάδων (έως 12 εβδομάδες, μέση εμφάνιση: 2 – 6 εβδομάδες) κατόπιν λοίμωξης από SARS-CoV-2, κυρίως σε παιδιατρικό και νεαρότερο πληθυσμό (υπεροχή στους άρρενες), με υψηλό εμμένον εμπύρετο (μέση διάρκεια έως την προσέλευση: 3 ημέρες) που απαιτεί νοσηλεία. Συνοδεύεται από πολυστηματικές κλινικές εκδηλώσεις: καρδιαγγειακές (θωρακικό άλγος, αίσθημα παλμών, ΗΚΓικές διαταραχές, αρρυθμίες, συστολική δυσλειτουργία, αύξηση τροπονίνης ή NT-pro-BNP), γαστρεντερικές (κοιλιακό άλγος για το οποίο συχνά απαιτείται χειρουργική εκτίμηση [8], εμετοί, διάρροιες ή απεικονιστικά σημεία εντερίτιδας), λεμφαδενοπάθεια, σπανιότερα δερματολογικές (εξάνθημα) και νευρολογικές (κεφαλαλγία, μηνιγγισμό). Αντιθέτως, απουσιάζει η έντονη συμπτωματολογία από το αναπνευστικό σύστημα [6] έτσι ώστε να αποκλείονται ασθενείς στους οποίους η φλεγμονή και η δυσλειτουργία των υπολοίπων οργάνων θα μπορούσε να αποδοθεί απλά στην ιστική υποξία· παρόλα αυτά μπορεί να παρουσιάζονται ήπια συμπτώματα αναπνευστικού, πλευριτικές συλλογές ή περιορισμένα απεικονιστικά ευρήματα θολής υάλου. Εργαστηριακώς, ανευρίσκονται πολύ υψηλοί δείκτες φλεγμονής (CRP, φερριτίνη) ή δείκτες διαταραχών πήξης (D-dimers, ινωδογόνο) ενώ η γενική αίματος μπορεί να παρουσιάζει λεμφοπενία, αναιμία
και θρομβοπενία. Οι RT-PCR για SARS-CoV-2 κατά την προσέλευση και τη νοσηλεία μπορεί να είναι αρνητικές αλλά να υπάρχουν θετικά για Sars-Cov2-IgG αντισώματα (συνηγορώντας σε πρόσφατη ανάρρωση από SARS-CoV-2 λοίμωξη) ή από το ιστορικό να υπάρχει εντός τριμήνου καταχωρημένη θετική RT-PCR για SARS-CoV-2.
H post-COVID-19 πολυστηματική φλεγμονώδης αντίδραση που ορίζεται με τα ανωτέρο κριτήρια, είναι μια όψιμη, σοβαρή και δυνητικά θανατηφόρα επιπλοκή της COVID-19 αν καταλήξει σε καρδιογενή καταπληξία αλλά η πρόγνωση βελτιώνεται σημαντικά όταν ο ασθενής λάβει εγκαίρως υποστηρικτική, φαρμακευτική (πχ αγωγή καρδιακής ανεπάρκειας), ανοσοτροπο- ποιητική θεραπεία (πχ κορτικοστεροειδή, ενδοφλέβια ανοσοσφαιρίνη) ή αιμοδυναμική υποστήριξη [5][7].
Η μεγάλη ετερογένεια της κλινικής παρουσίασης της μυοκαρδίτιδας – πόσο μάλλον στα πλαίσια του post-COVID-19 πολυσυστηματικού φλεγμονώδους συνδρόμου του παρόντος περιστατικού – σε συνδυασμό με τη δυσχερή διενέργεια βιοψίας μυοκαρδίου στην καθημερινή κλινική πράξη, έχουν καταστήσει την καρδιακή απεικόνιση κομβικής σημασίας για τη διάγνωση, την αιτιολογική και προγνωστική αξιολόγηση της μυοκαρδιακής φλεγμονής και τη συνακόλουθη κλινική διαχείριση του ασθενούς. Παρακάτω, συνοψίζεται ο ρόλος της υπερηχοκαρδιογραφίας και των επιπρόσθετων μη επεμβατικών απεικονιστικών τεχνικών στο κλινικό σενάριο της μυοκαρδίτιδας.
Υπερηχοκαρδιογραφία
Διαθωρακική υπερηχοκαρδιογραφία (ΤΤΕ)
Η διαθωρακική υπερηχοκαρδιογραφία (ΤΤΕ) λόγω της ευρείας διαθεσιμότητας, φορητότητας και ταχείας διενέργειάς της αποτελεί εξέταση πρώτης γραμμής σε υποψία μυοκαρδίτιδας καθώς είναι ιδιαίτερα χρήσιμη στον αρχικό αποκλεισμό παθήσεων που μπορεί να υποδυθούν παρόμοια κλινική εικόνα (πχ. αορτικός διαχωρισμός, βαλβιδική νόσος, μυοκαρδιοπάθειες κ.α)[9][10]. Τα υπερηχογραφικά ευρήματα σε παρουσία μυοκαρδίτιδας είναι ποικίλης βαρύτητας και μπορεί να περιλαμβάνουν γενικευμένη συστολική δυσλειτουργία, τμηματικές τοιχωματικές υποκινησίες ή και διαστολική δυσλειτουργία με διατηρημένο κλάσμα εξώθησης. Η αριστερή κοιλία μπορεί να απεικονισθεί διατεταμένη ή ακόμη και φυσιολογικού μεγέθους αλλά με αυξημένο πάχος τοιχωμάτων λόγω μυοκαρδιακού οιδήματος, απότοκου της έντονης φλεγμονής (εικόνα παρατηρούμενη σε συνδυασμό με έκπτωση συσταλτικότητας σε περιπτώσεις κεραυνοβόλου μυοκαρδίτιδας)[11][12][13]. Ακόμη, είναι συχνή η ανεύρεση περικαρδιακής συλλογής πιστοποιώντας την ύπαρξη περιμυοκαρδίτιδας, ενώ σπανιότερα ανευρίσκονται και θρόμβοι[14][15]. Τέλος, αξίζει να επισημανθεί ότι η απουσία παθολογικής σημειολογίας στην υπερηχογραφική μελέτη δεν αποκλείει τη διάγνωση πιθανής μυοκαρδίτιδος.
Σημαντικό συγκριτικό πλεονέκτημα της υπερηχοκαρδιογραφίας (όπως χρησιμοποιήθηκε και στο παρόν περιστατικό) έναντι των υπολοίπων απεικονιστικών τεχνικών αποτελεί η δυνατότητα της ευχερούς επανεκτίμησης και παρακολούθησης (monitoring)[9] των παρατηρούμενων αλλαγών κατά τη δυναμική εξέλιξη της οξείας μυοκαρδίτιδας (πχ. επανεκτίμηση της μυοκαρδιακής λειτουργίας, του μεγέθους των κοιλιών και του πάχους των τοιχωμάτων ή του μεγέθους συνυπάρχουσας περικαρδιακής συλλογής).
Πέραν του πρωταρχικού ρόλου της υπερηχοκαρδιογραφίας στη διάγνωση και την παρακολούθηση της εξέλιξης της οξείας μυοκαρδίτιδας, αρκετές υπερηχογραφικές παράμετροι έχουν χρησιμοποιηθεί και ως προγνωστικοί παράγοντες της κλινικής πορείας του ασθενούς. Οι ασθενείς με υπερηχογραφική εικόνα κεραυνοβόλου μυοκαρδίτιδας (σχεδόν φυσιολογικές διαστάσεις LV, αυξημένο πάχος τοιχωμάτων, συστολική και διαστολική δυσλειτουργία – περιοριστικό πρότυπο) εάν επιβιώσουν της οξείας φάσης παρουσιάζουν σημαντική ανάκαμψη της συστολικής λειτουργίας στους 6 μήνες (φυσιολογικοποίηση του κλάσματος εξώθησης στο 60% των ασθενών) συγκριτικά με αυτούς που παρουσιάστηκαν με εικόνα μη κεραυνοβόλου οξείας μυοκαρδίτιδας (αυξημένες διαστάσεις LV, φυσιολογικό ή λεπτό πάχος τοιχωμάτων, κυμαινόμενη διαταραχή συστολικής ή διαστολικής λειτουργίας)[11]. Παρόμοια, και σε παιδιατρικό πληθυσμό με οξεία μυοκαρδίτιδα και έκπτωση συσταλτικότητας κατά την προσέλευση, διαπιστώθηκε ότι η απουσία αυξημένων τελοδιαστολικών διαστάσεων και το μεγαλύτερο πάχος τοιχωμάτων συσχετίστηκαν με καλύτερη κλινική έκβαση [16][17].Όπως και σε όλες τις περιπτώσεις καρδιακής ανεπάρκειας, η ανεύρεση μειωμένης λειτουργικότητας της δεξιάς κοιλίας αποτελεί ανεξάρτητο προγνωστικό παράγοντα θανάτου ή ανάγκης για μεταμόσχευση σε ασθενείς με οξεία μυοκαρδίτιδα [18][19].
Κατά το follow-up των ασθενών (στους 6 μήνες) με παρελθούσα μυοκαρδίτιδα, διαπιστώθηκε ότι εκτός από την ανάκαμψη του κλάσματος εξώθησης και η ανεύρεση βελτιωμένης διαστολικής δυσλειτουργίας αποτελεί ανεξάρτητο προγνωστικό
παράγοντα καλύτερης κλινικής έκβασης[20].
Κατά τη διάρκεια της πανδημίας COVID-19 η ΤΤΕ ανέδειξε παρόμοια υπερηχογραφικά ευρήματα[21] και σε ασθενείς νοσούντες με λοίμωξη SARS-CoV-2 και μυοκαρδίτιδα, εκτεινόμενα από φυσιολογικά ευρήματα έως και σοβαρή συστολική δυσλειτουργία ή οίδημα σε περιπτώσεις κευρανοβόλου μυοκαρδίτιδας[22]. Αξίζει να σημειωθεί ότι η χρήση της διαθωρακικής υπερηχοκαρδιογραφίας με τη μορφή φορητών συσκευών pocket-size εφαρμόζοντας πρωτόκολλα POCUS υπήρξε η πρώτη γραμμή διαγνωστικής προσέγγισης και παρακολούθησης των καρδιαγγειακών επιπλοκών των ασθενών με (COVID-19) λόγω της ταχύτητας της εξέτασης, της δυνατότητας διενέργειάς της παρά την κλίνη του ασθενούς ανεξαρτήτως αιμοδυναμικής κατάστασης αλλά και της ευχερούς απολύμανσης των συσκευών [23].
Σε αντιδιαστολή με την προηγούμενη παράθεση των πλεονεκτημάτων της ΤΤΕ αξίξει να υπογραμμισθεί ότι η υπερηχογραφική διαφορική διάγνωση στην κλινική πράξη συχνά είναι δυσχερής, ιδίως μεταξύ μυοκαρδίτιδος και οξέος στεφανιαίου συνδρόμου καθώς τα υπερηχογραφικά ευρήματα (είτε επί παρουσίας είτε επί απουσίας τμηματικών τοιχωματικών υποκινησιών ή γενικευμένης μυοκαρδιακής δυσλειτουργίας) μεταξύ των δύο παθήσεων είναι μη ειδικά και κατα συνέπεια απαιτείται συνολική κλινικοεργαστηριακή αξιολόγηση του ασθενούς και επιστράτευση επιπρόσθετων απεικονιστικών μεθόδων.
Συμπερασματικά και σύμφωνα με τις οδηγίες της Ευρωπαικής Καρδιολογικής Εταιρείας Καρδιαγγειακής Απεικόνισης[9], η διενέργεια διαθωρακικής υπερηχογραφίας συνιστάται (class ΙC) τόσο κατά την προσέλευση σε όλους τους ασθενείς με κλινική υποψία μυοκαρδίτιδας όσο και επαναληπτικά κατά τη διάρκεια της νοσηλείας, ίδιως επί ενδείξεων αιμοδυναμικής επιβάρυνσης.
Απεικόνιση μυοκαρδιακής παραμόρφωσης (Strain imaging)
Η απεικόνιση της μυοκαρδιακής παραμόρφωσης αναδεικνύεται ως ένα χρήσιμο διαγνωστικό και προγνωστικό εργαλείο στη διαχείριση ασθενών με μυοκαρδίτιδα.
Η εκτίμηση τόσο της συνολικής όσο και της τμηματικής μυοκαρδιακής παραμόρφωσης αναγνωρίστηκε ως πιο ευαίσθητος δείκτης εντόπισης και ποσοτικοποίησης της μυοκαρδιακής δυσλειτουργίας έναντι του κλάσματος εξώθησης και της οπτικής αξιόλογησης (eyeball assessment) της καρδιακής λειτουργίας σε ασθενείς με ενεργό μυοκαρδίτιδα[24]. Μάλιστα, η αξία της απεικόνισης της μυοκαρδιακής παραμόρφωσης είναι μεγαλύτερη σε ασθενείς με διατηρημένο κλάσμα εξώθησης χωρίς εμφανείς τμηματικές τοιχωματικές υποκινησίες και σε περιστάσεις όπου η πρόσβαση σε μαγνητική τομογραφία καρδιάς είναι περιορισμένη. Ακόμη, η τεχνική ανίχνευσε επιτυχώς λανθάνουσα μυοκαρδιακή δυσλειτουργία σε ασθενείς με ιστορικό μη σοβαρής μυοκαρδίτιδας και διατηρημένο κλάσμα εξώθησης στη συμβατική υπερηχοκαρδιογραφία [25].
Επίσης, διαπιστώθηκε ότι ο δείκτης μυοκαρδιακής παραμόρφωσης συνεχίζει να παραμένει ελλατωμένος σε ασθενείς με εμμένουσα ενεργό μυοκαρδιακή φλεγμονή και συσχετίσθηκε σημαντικά με παραμένουσα μυοκαρδιακή λεμφοκυτταρική διήθηση, αναδεικνύοντάς τον ως χρήσιμο επικουρικό εργαλείο παρακολούθησης της πορείας της οξείας μυοκαρδίτιδας[26].
Ακόμη, η ανεύρεση μειωμένου δείκτη μυοκαρδιακής παραμόρφωσης συσχετίσθηκε προγνωστικά με χειρότερη κλινική έκβαση (καρδιογενής καταπληξία, πλήρης κολποκοιλιακός αποκλεισμός, ανακοπή, καρδιακός θάνατος) και παρατηρήθηκε ισχυρότερη συσχέτιση στους ασθενείς με διατηρημένο κλάσμα εξώθησης[27].
Στα πλαίσια της πανδημίας (COVID-19), η μειωμένη μυοκαρδιακή παραμόρφωση της δεξιάς κοιλίας (RV-LS) αποτελεί ισχυρό ανεξάρτητο παράγοντα πτωχότερης πρόγνωσης[28] ενώ και η μειωμένη μυοκαρδιακή παραμόρφωση της αριστερής κοιλίας (LV-GLS) συνδέεται επίσης με αυξημένη θνητότητα ασθενών με (COVID-19)[29][30]. Ακόμη, σύμφωνα με την μελέτη των Shmueli et al ανευρέθηκε εντοπισμένη μυοκαρδιακή τμηματική υπερηχογένεια σε 74% ασθενών νοσηλευόμενων με (COVID-19) η οποία συσχετιζόταν με παθολογική μυοκαρδιακή παραμόρφωση στην αντίστοιχη τμηματική μυοκαρδιακή κατανομή[31].
Αξίξει να υπογραμμισθεί ότι η διαγνωστική ειδικότητα της απεικόνισης της μυοκαρδιακής παραμόρφωσης περιορίζεται σημαντικά όταν η οξεία μυοκαρδίτιδα επισυμβαίνει σε έδαφος χρόνιας μυοκαρδιοπάθειας.
Καθώς οι περισσότερες μελέτες που αφορούν την μυοκαρδιακή παραμόρφωση στην οξεία μυοκαρδίτιδα παρουσίαστηκαν αργότερα από τη δημοσίευση των οδηγιών της ευρωπαικής καρδιολογικής εταιρείας (ESC position statement 2013), δε διατυπώθηκαν σχετικές συστάσεις[9].
Επιπρόσθετες απεικονιστικές τεχνικές.
Μαγνητική τομογραφία καρδιάς (CMR)
Η μαγνητική τομογραφία καρδιάς πέραν της υψηλότερης διαγνωστικής ακρίβειας έναντι της διαθωρακικής υπερηχοκαρδιογραφίας στην αξιολόγηση λειτουργικών και ανατομικών χαρακτηριστικών (μέγεθος, μορφολογία και λειτουργικότητα αριστερής και δεξιάς κοιλίας, εντόπιση περικαρδιακής συλλογής) προσφέρει τη δυνατότητα ανίχνευσης σημειολογίας συμβατής με μυοκαρδίτιδα στο ιστικό επίπεδο του μυοκαρδίου, όπως είναι το μυοκαρδιακό οίδημα και η ίνωση.
Οι κατευθυντήριες οδηγίες συνιστούσαν παραδοσιακά την ανεύρεση τουλάχιστον 2 εκ των 3ων συνολικά διαγνωστικών κριτηρίων (79% διαγνωστική ακρίβεια) ιστικού χαρακτηρισμού της μυοκαρδίτιδας (Lake Louise criteria)[32]: 1) οίδημα (ενίσχυση σήματος στις Τ2 ακολουθίες), 2) υπεραιμία (πρώιμος εμπλουτισμός γαδολινίου) καθώς και 3) ίνωση (υποεπικαρδιακή συχνότερα πρόσληψη γαδολινίου κατά την τεχνική του καθυστερημένου εμπλουτισμού γαδολινίου, Late Gadolinium Enhancement – LGE). Οι νεότερες τεχνικές Τ1 και Τ2 χαρτογράφησης (Τ1 – Τ2 mapping) παρέχουν επιπλέον τη δυνατότητα ποσοτικής εκτίμησης της μυοκαρδιακής φλεγμονής και αυξάνουν τη συνολική διαγνωστική ακρίβεια των παραδοσιακών κριτηρίων Lake Louise, έτσι ώστε πλέον να συνιστώνται από την Ευρωπαική Εταιρεία καρδιαγγειακής απεικονισης σε υποψία μυοκαρδίτιδας[33]. Ακόμη, η μαγνητική τομογραφία καρδιάς μπορεί να απεικονίσει τυχόν επινέμηση της φλεγμονής και στο περικάρδιο πιστοποιώντας έτσι τη διάγνωση της περιμυοκαρδίτιδας. Έχει καταδειχθεί από μικρές μελέτες ότι το μοτίβο εμπλουτισμού του γαδολινίου στην τεχνική LGE μπορεί να σχετίζεται με συγκεκριμένο παθογόνο ιό (πχ ο ιός parvo B19 προκαλεί νέκρωση στο πλάγιο τοίχωμα, ενώ ο ιός του έρπητα HSV-6 προκαλεί ίνωση του διαφραγματικού τοιχώματος)[34]. Τέλος, η μαγνητική τομογραφία καρδιάς μπορεί να χρησιμοποιηθεί σε κλινικά σταθερούς ασθενείς με οξεία μυοκαρδίτιδα προ της βιοψίας μοκαρδίου για να κατευθύνει και να αυξήσει τη διαγνωστική της ακρίβεια[35].
Πέραν της διαγνωστικής της αξίας, η έκταση και η κατανομή της μυοκαρδιακής νέκρωσης, μέσω της τεχνικής του καθυστερημένου εμπλουτισμού γαδολινίου LGE, αποτελούν ανεξάρτητους προγνωστικούς παράγοντες καρδιακών συμβαμάτων[36][37][38][39].Συγκεκριμένα, 10% αύξηση της έκτασης του LGE συνδέεται με 79% αύξηση του κινδύνου εμφάνισης σημαντικών καρδιακών συμβαμάτων [40]. Αν και γενικά συστήνεται αποχή του ασθενούς από αθλητικές δραστηριότητες για διάστημα 3 έως 6 μηνών[41], ο ακριβής χρόνος επιστροφής μπορεί να καθορισθεί από την παρουσία φλεγμονής στις T2 ακολουθίες και την έκταση και κατανομή του LGE. Μάλιστα, εάν η CMR κατά τη διάρκεια της οξείας φάσης αναδείξει μυοκαρδιακό οίδημα ή LGE τότε συνιστάται επανάληψη της εξέτασης μετά από 3-6 μήνες. Οι ασθενείς με παρελθούσα μυοκαρδίτιδα και παραμονή LGE αλλά χωρίς παρουσία μυοκαρδιακού οιδήματος στην επαναληπτική CMR μπορούν να επιστρέψουν στην αθλητική δραστηριότητα αφού εξεταστούν κατά περίπτωση και εφόσον πληρούνται επιπλέον κριτήρια (ασυμπτωματικοί, φυσιολογική τροπονίνη και δείκτες φλεγμονής, φυσιολογική λειτουργία LV, φυσιολογική δοκιμασία κόπωσης και holter ρυθμού)[42]. Αντίθετα, ασθενείς με εκτεταμένη μυοκαρδιακή ίνωση (>20% LGE) και εμμένουσα δυσλειτουργία της αριστερής κοιλίας συνιστάται να απέχουν από άθληση υψηλής ή μέτριας έντασης[41]. Ακόμη, η παραμένουσα LGE χωρίς συνοδό οίδημα στην επαναληπτική CMR (6μηνο) συσχετίζεται με χειρότερη πρόγνωση, ιδίως όταν εμφανίζει μεσοτοιχωματική διαφραγματική κατανομή, διότι αντιπροσωπεύει πιθανώς οριστική ίνωση εν αντίθεσει με τη συνοδό παρουσία οιδήματος η οποία μπορεί να είναι ενδεικτική παραμένουσας πιθανότητας ανάκαμψης[43]. Τέλος, αξίζει να σημειωθεί ότι ασθενείς με ιστορικό μυοκαρδίτιδας παρουσιάζουν αυξημένο κίνδυνο επανεμφάνισης [44]ή ακόμη και εξέλιξης υποκλινικής μυοκαρδίτιδας[39][45], γι΄αυτό και συνιστάται περιοδική επανεκτίμηση σε ετήσια βάση, ιδίως σε παρουσία LGE κατά την οξεία φάση.
Στα πλαίσια της πανδημίας (COVID-19), η μαγνητική τομογραφία καρδίας εκτός από την καθιερωμένη συμβολή της στη διάγνωση μυοκαρδίτιδος κατά την οξεία φάση της νόσου παρουσιάζει υψηλή διαγνωστική αξία στην ανίχνευση υποκλινικής μυοκαρδιακής προσβολής σε σημαντικό ποσοστό (78%) – και μάλιστα σε ποσοστό 60% ανάδειξης ενεργού φλεγμονής – σε ασθενείς με ιστορικό πρόσφατης λοίμωξης από SARS-CoV-2 (71 ημέρες μετά), συμπεριλαμβανομένων ασθενών για τους οποίους δεν απαιτήθηκε νοσηλεία κατά την οξεία φάση της νόσου σύμφωνα με γερμανική μελέτη[46]. Ανάλογα ευρήματα, αλλά με χαμηλότερα ποσοστά (≈ 60% μη φυσιολογικά ευρήματα, ανεύρεση LGE ≈ 30%) διαπιστώθηκαν και από άλλες μελέτες σε ασθενείς που ανάρρωσαν από (COVID-19)[47][48][49]. H διενέργεια CMR σε πληθυσμό αθλητών με πρόσφατη λοίμωξη SARS-CoV-2 (ασυμπτωματική/ήπια νόσηση) ανέδειξε πρωτίστως υψηλό ποσοστό μεμονωμένης περικαρδιακής συμμετοχής (48%, της οποίας η κλινική σημασία σε ασυμπτωματικούς ασθενείς δεν έχει ακόμα εξακριβωθεί), μεμονωμένη μυοκαρδιακή συμετοχή (30%) ή μυοπερικαρδιακή συμμετοχή (22%), ενώ δε διαπιστώθηκε κανένας αθλητής με εικόνα μυοκαρδίτιδας σύμφωνη με τα αναθεωρημένα Lake Louise κριτήρια[50]. Πολύ χαμηλά ποσοστά μυοκαρδίτιδας (1.4%) σε αθλητές επιβεβαίωσε και η μελέτη των Starekova et al σύμφωνα με τα ίδια κριτήρια[51].
Η χρησιμότητα της μαγνητικής τομογραφίας καρδιάς στην κλινική πράξη περιορίζεται σε περιπτώσεις αιμοδυναμικής αστάθειας, ιδίως σε ασθενείς με άρρυθμο ταχύ καρδιακό ρυθμό και σε ασθενείς υπό μηχανικό αερισμό[18]. Σε αυτές τις περιπτώσεις ασθενών συνιστάται βιοψία μυοκαρδίου (ΑΗΑ, ΕSC class 1B) η οποία θα προσφέρει τόσο διαγνωστικές πληροφορίες, καθοριστικές για την επιλογή θεραπείας, όσο και προγνωστικές πληροφορίες [52]. Ακόμη, αξίζει να επισημανθεί ότι η μαγνητική τομογραφία καρδιάς εμφανίζει μεγαλύτερη διαγνωστική ακρίβεια όταν διενεργείται έως και 2-3 εβδομάδες από την έναρξη των συμπτωμάτων προκειμένου να μπορεί να απεικονιστεί το οίδημα του μυοκαρδίου[33]. Αντιθέτως, σε περιπτώσεις όπου η διάρκεια της νόσου είναι μεγαλύτερη από 3 μήνες, όπως σε ασθενείς με αρχόμενη καρδιακή ανεπάρκεια, η διαγνωστική ακρίβεια της εξέτασης είναι χαμηλότερη[32]. Η ευαισθησία της εξέτασης είναι επίσης μεγαλύτερη σε περιπτώσεις μυοκαρδίτιδας προσομοιάζουσας οξέος στεφανιαίου συνδρόμου (στηθάγχη, αυξημένη τροπονίνη) έναντι αυτών που παρουσιάζονται με εικόνα καρδιακής ανεπάρκειας ή αρρυθμιών [53][54]. Τέλος, πέραν των κλασικών μειονεκτημάτων της CMR (μειωμένη διαθεσιμότητα, διάρκεια εξέτασης, κλειστοφοφία), κατά τη διάρκεια της πανδημίας (COVID-19) προστίθενται και οι περιορισμοί της ανάγκης αξιολόγησης αυξημένου ποσοστού ασθενών σε κριτική κατάσταση καθώς και της απαιτούμενης απολύμανσης του χώρου και του τομογράφου.
Συμπερασματικά, η μαγνητική τομογραφία καρδιάς αποτελεί σημαντικό διαγνωστικό (με υψηλή ευαισθησία και ειδικότητα) και προγνωστικό εργαλείο στη διαχείριση ασθενούς με κλινική υποψία μυοκαρδίτιδας και συνιστάται από τις ευρωπαικές κατευθυντήριες οδηγίες τόσο για τη διαφοροδιάγνωση (class IB) μεταξύ μυοκαρδίτιδας, εμφράγματος μυοκαρδίου και Takotsubo μυοκαρδιοπάθειας όσο και για την αναγνώριση μυοκαρδιακής συμμετοχής σε περικαρδιακά σύνδρομα (μυοπερικαρδίτιδα)(class IC) αλλά και για το follow-up του ασθενούς με παρελθούσα μυοκαρδίτιδα[41].
Αξονική τομογραφία καρδιάς (CCTA)
Σε κάθε ασθενή με κλινική υποψία μυοκαρδίτιδας, σύμφωνα με τις ευρωπαικές κατευθυντήριες οδηγίες, συνιστάται η διενέργεια στεφανιογραφικού ελέγχου προς αποκλεισμό οξέος στεφανιαίου συνδρόμου. Επομένως, η αξονική στεφανιογραφία αποτελεί εναλλακτική επιλογή σε ασθενείς χαμηλής ή μέτριας πιθανότητας ύπαρξης στεφανιαίας νόσου (όπως ο ασθενής του παρόντος περιστατικού) [55] και επιπλέον μπορεί να αποκαλήψει μια μυοκαρδιακή γέφυρα ή ανώμαλη έκφυση των στεφανιαίων αρτηριών που θα μπορούσαν να προκαλέσουν προκάρδια συμπτώματα. Ταυτόχρονα, η άμεση διενέργεια της αξονικής επιτρέπει διαφοροδιαγνωστικά και τον περαιτέρω αποκλεισμό επιπρόσθετων επειγουσών παθήσεων όπως είναι η πνευμονική εμβολή και ο αορτικός διαχωρισμός (triple rule out)[56] ή ακόμη και να πληροφορήσει για ενδεχόμενη παθολογία του πνευμονικού παρευγχύματος ή του υπεζοκώτα.
Ακόμη, η δυνατότητα ιστικού χαρακτηρισμού μέσω καθυστερημένης έγχυσης ιωδιούχου σκιαστικού και της συνακόλουθης ανίχνευσης μυοκαρδιακής βλάβης και μυοκαρδίτιδας[57] προσδίδει στην αξονική τομογραφία την ικανότητα για “quadruple rule out” (τετραπλό αποκλεισμό) στεφανιαίας νόσου, πνευμονίας, πνευμονικής εμβολής και μυοκαρδίτιδας κατά τη διάρκεια μίας εξέτασης (με τροποποιημένο πρωτόκολλο αυξάνοντας κατά λίγο τη διάρκεια της εξέτασης), γεγονός που την καθιστά πολύτιμη σε συνθήκες πανδημίας (COVID-19)[23][58].
Μελλοντικές κατευθύνσεις – προοπτικές
Είναι αδιαμφισβήτητο ότι η καρδιαγγειακή απεικόνιση θα συνεχίσει να κατέχει κεντρικό ρόλο στην κλινική διαχείριση ασθενών με υποψία μυοκαρδίτιδας και αναμένεται περαιτέρω βελτιστοποίηση των ήδη υπαρχουσών τεχνικών ή ακόμη και χρήση εναλλακτικών απεικονιστικών προσεγγίσεων τα επόμενα έτη.
Σύμφωνα με πρόσφατες μελέτες η αξονική τομογραφία καρδιάς επέδειξε συγκρίσιμη διαγνωστική ακρίβεια (95%) σε σχέση με τη μαγνητική τομογραφία καρδιάς ως προς την αναγνώριση μυοκαρδιακής και περικαρδιακής φλεγμονής μέσω της ανίχνευσης καθυστερημένης ενίσχυσης ιωδιούχου σκιαστικού (late iodine enhancement, LIE)[59]. Η δυνατότητα της άμεσης και ταυτόχρονης αξιολόγησης τόσο των στεφανιαίων αγγείων όσο και του μυοκαρδιακού ιστικού χαρακτηρισμού προσδίδουν στην αξονική τομογραφία δυναμική για ευρύτερη μελλοντική της χρήση στο συγκεκριμένο κλινικό πλαίσιο ενώ αναμένονται και αποτελέσματα τρεχουσών
κλινικών μελετών (AP-HP, NCT02905721). Πέραν της ταχύτερης διαδικασίας, η αξία της αξονικής τομογραφίας είναι ακόμα μεγαλύτερη σε περιπτώσεις ασθενών που φέρουν μεταλλικά εμφυτεύματα ή έχουν κλειστοφοβία και όπου δεν είναι διαθέσιμη η μαγνητική τομογραφία καρδιάς.Η μαγνητική τομογραφία καρδίας αν και ήδη αποτελεί καθιερωμένη απεικονιστική τεχνική με υψηλή διαγνωστική ακρίβεια η οποία βελτιώθηκε περαιτέρω με την εισαγωγή των νεότερων τεχνικών της χαρτογράφησης, ενδέχεται να αυξήσει ακόμη περισσότερο και την προγνωστική της αξία με την ταυτόχρονη χρήση της τεχνικής μυοκαρδιακής παραμόρφωσης (feature tracking, CMR-FT)[60]. Φαίνεται ότι η CMR-FT προσφέρει ανεξάρτητο και επιπρόσθετο προγνωστικό όφελος έναντι άλλων κλινικών χαρακτηριστικών και παραδοσιακών απεικονιστικών δεικτών της μαγνητικής τομογραφίας καρδιάς, όπως είναι το κλάσμα εξώθησης και ο καθυστερημένος εμπλουτισμός γαδολινίου σε ασθενείς με πιθανή μυοκαρδίτιδα.
Εναλλακτικές υβριδικές τεχνικές που συνδυάζουν τη μαγνητική τομογραφία καρδιάς με την τομογραφία εκπομπής ποζιτρονίων (PET/CMR) φαίνεται να υπερέχουν τόσο στην παρακολούθηση της ενεργότητας της μυοκαρδιακής φλεγμονής όσο και διαγνωστικά σε περιπτώσεις όπου είναι επισφαλή τα ευρήματα της μαγνητικής τομογραφίας ή όταν δεν είναι σαφής ο διαχωρισμός μεταξύ οξείας και εμμένουσας χρόνιας μυοκαρδίτιδας[61]. Η αυξημένη πρόσληψη 18F-FDG η οποία παρατηρείται στα φλεγμονώδη κύτταρα θα μπορούσε να χρησιμοποιηθεί συμπληρωματικά των “Lake Louise” κριτηρίων κατά τη μη επεμβατική καρδιαγγειακή αξιολόγηση ασθενών με υποψία μυοκαρδίτιδας. Μελέτες έχουν ήδη αναδείξει την ανωτερότητα της υβριδικής τεχνικής (PET/CMR) κατά την εφαρμογή της σε περιπτώσεις καρδιακή σαρκοείδωσης μέσω της ταυτόχρονης και συμπληρωματικής αξιολόγησης τόσο του ιστικού χαρακτηρισμού όσο και της μεταβολικής δραστηριότητας του μυοκαρδίου.
Τέλος, η ανάπτυξη της νεότερης γενιάς σκιαγραφικών μέσων υπερηχοκαρδιογραφίας επέτρεψε σε ερευνητικό επίπεδο τη δυνατότητα της μοριακής απεικόνισης. Οι μικροφυσαλλίδες (νανοσταγονίδια μεταβαλλόμενης φάσης) των νεότερων σκιαγραφικών μέσων φέροντας συγκεκριμένους υποδοχείς πρόσδεσης στην επιφάνεια τους, στοχεύουν σε ενδαγγειακές μοριακές οντότητες όπως είναι η ενδοθηλιακή φλεγμονή και η λεμφοκυτταρική διήθηση σε περιπτώσεις μυοκαρδίτιδας. Αναμένεται στο άμεσο μέλλον το κατά πόσον η ερευνητική δυναμική της μοριακής απεικόνισης θα μεταφρασθεί κλινικά στη διάγνωση και θεραπεία της καρδιαγγειακής νόσου σε ανθρώπινο πληθυσμό [62][63].
Key Learning Points
- Το Πολυσυστηματικό Φλεγμονώδες Σύνδρομο (Multisystem Inflammatory Syndrome, MIS) μετά από λοίμωξη COVID-19 αποτελεί μία σπάνια αλλά σοβαρή όψιμη επιπλοκή σε ασθενείς με αποδραμούσα ή προσφάτως παρελθούσα λοίμωξη από SARS-CoV-2 με πρωταρχικές καρδιαγγειακές και γαστρεντερικές κλινικές εκδηλώσεις.
- H ετερογένεια της κλινικής παρουσίασης, το ευρύ διαφοροδιαγνωστικό φάσμα και η τεχνικά δυσχερής βιοψία μυοκαρδίου καθιστούν αναγκαία την καρδιαγγειακή απεικόνιση στην κλινική διαχείριση (διάγνωση, πρόγνωση, monitoring, follow-up) των ασθενών με υποψία μυοκαρδίτιδας.
- Η διαθωρακική υπερηχοκαρδιογραφία (ΤΤΕ) αποτελεί εξέταση 1ης γραμμής σε υποψία μυοκαρδίτιδας καθώς είναι ιδιαίτερα χρήσιμη τόσο στην αρχική διαφορική διάγνωση όσο και για την παρακολούθηση της κλινικής πορείας κατά τη νοσηλεία.
- Η μαγνητική τομογραφία καρδιάς (CMR) αποτελεί σημαντικό διαφοροδια- γνωστικό και προγνωστικό εργαλείο τόσο σε αιμοδυναμικά σταθερούς ασθενείς με κλινική υποψία μυοκαρδίτιδας όσο και για το follow-up του ασθενούς με παρελθούσα μυοκαρδίτιδα.
- Καθώς σε κάθε ασθενή με υποψία μυοκαρδίτιδας συνιστάται έλεγχος των στεφανιαίων αγγείων προς αποκλεισμό οξέος στεφανιαίου συνδρόμου, η αξονική στεφανιογραφία (CTCA) αποτελεί εναλλακτική επιλογή σε ασθενείς χαμηλής ή μέτριας πιθανότητας ύπαρξης στεφανιαίας νόσου.
- Η χρήση της αξονικής τομογραφίας (CT) τόσο για τον αποκλεισμό στεφανιαίας νόσου όσο και για μυοκαρδιακό ιστικό χαρακτηρισμό, η εισαγωγή της τεχνικής feature tracking (CMR-FT) κατά τη μαγνητική τομογραφία καρδιάς, οι υβριδικές απεικονιστικές τεχνικές (PET/CMR) και η Μοριακή Απεικόνιση αποτελούν αναδυόμενες μη επεμβατικές διαγνωστικές προσεγγίσεις σε υποψία μυοκαρδίτιδας.
Βιβλιογραφία
[1] S. Riphagen, X. Gomez, C. Gonzalez-Martinez, N. Wilkinson, and P. Theocharis, “Hyperinflammatory shock in children during COVID-19 pandemic,” Lancet, vol. 395, no. 10237, pp. 1607–1608, 2020, doi: 10.1016/S0140-6736(20)31094-1.
[2] I. Valverde et al., “Acute Cardiovascular Manifestations in 286 Children With Multisystem Inflammatory Syndrome Associated With COVID-19 Infection in Europe,” Circulation, vol. 143, no. 1, pp. 21–32, Jan. 2021, doi: 10.1161/CIRCULATIONAHA.120.050065.
[3] J. H. Rubens, N. P. Akindele, M. M. Tschudy, and A. C. Sick-Samuels, “Acute covid-19 and multisystem inflammatory syndrome in children,” BMJ, vol. 372, pp. 1–6, 2021, doi: 10.1136/bmj.n385.
[4] S. Godfred-Cato et al., “COVID-19–Associated Multisystem Inflammatory Syndrome in Children — United States, March–July 2020,” MMWR. Morb. Mortal. Wkly. Rep., vol. 69, no. 32, pp. 1074–1080, Aug. 2020, doi: 10.15585/mmwr.mm6932e2.
[5] R. Bajaj et al., “Delayed-onset myocarditis following COVID-19.,” Lancet. Respir. Med., vol. 2600, no. 21, pp. 85–87, 2021, doi: 10.1016/S2213-2600(21)00085-0.
[6] S. B. Morris et al., “Case Series of Multisystem Inflammatory Syndrome in Adults Associated with SARS-CoV-2 Infection — United Kingdom and United States, March–August 2020,” MMWR. Morb. Mortal. Wkly. Rep., vol. 69, no. 40, pp. 1450–1456, 2020, doi: 10.15585/mmwr.mm6940e1.
[7] V. Q. Chau et al., “Cardiogenic shock and hyperinflammatory syndrome in young males with COVID-19,” Circ. Hear. Fail., no. October, pp. 556–559, 2020, doi: 10.1161/CIRCHEARTFAILURE.120.007485.
[8] J. R. Lechien, R. Hervochon, and S. Hans, “Post-COVID-19 Kawasaki-Like Syndrome.,” Ear. Nose Throat J., p. 1455613211006011, 2021, doi: 10.1177/01455613211006011.
[9] A. L. P. Caforio et al., “Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: A position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases,” Eur. Heart J., vol. 34, no. 33, pp. 2636–2648, 2013, doi: 10.1093/eurheartj/eht210.
[10] L. T. Cooper, “Myocarditis,” N. Engl. J. Med., vol. 360, no. 15, pp. 1526–1538, Apr. 2009, doi: 10.1056/NEJMra0800028.
[11] G. M. Felker et al., “Echocardiographic findings in fulminant and acute myocarditis,” J. Am. Coll. Cardiol., vol. 36, no. 1, pp. 227–232, Jul. 2000, doi: 10.1016/S0735-1097(00)00690-2.
[12] S. K. Shillcutt, W. R. Thomas, J. N. Sullivan, and A. Duhachek-Stapelman, “Fulminant myocarditis: The role of perioperative echocardiography,” Anesth. Analg., vol. 120, no. 2, pp. 296–299, 2015, doi: 10.1213/ANE.0000000000000508.
[13] H. N. Skouri, G. W. Dec, M. G. Friedrich, and L. T. Cooper, “Noninvasive Imaging in Myocarditis,” J. Am. Coll. Cardiol., vol. 48, no. 10, pp. 2085–2093, Nov. 2006, doi: 10.1016/j.jacc.2006.08.017.
[14] J. Kojima, S. Miyazaki, H. Fujiwara, T. Kumada, and C. Kawai, “Recurrent left ventricular mural thrombi in a patient with acute myocarditis,” Heart Vessels, vol. 4, no. 2, pp. 120–122, Jun. 1988, doi: 10.1007/BF02059000.
[15] N. J. Whitehead, S. Murch, J. W. Leitch, and R. A. Hackworthy, “Acute myocarditis with thrombus near left ventricular outflow tract,” Echocardiography, vol. 35, no. 4, pp. 575–577, Apr. 2018, doi: 10.1111/echo.13840.
[16] S. R. Foerster et al., “Ventricular Remodeling and Survival Are More Favorable for Myocarditis Than For Idiopathic Dilated Cardiomyopathy in Childhood,” Circ. Hear. Fail., vol. 3, no. 6, pp. 689–697, Nov. 2010, doi: 10.1161/CIRCHEARTFAILURE.109.902833.
[17] G. Kim, G.-H. Ban, H.-D. Lee, S.-C. Sung, H. Kim, and K.-H. Choi, “Left ventricular end-diastolic dimension as a predictive factor of outcomes in children with acute myocarditis,” Cardiol. Young, vol. 27, no. 3, pp. 443–451, Mar. 2017, doi: 10.1017/S1047951116000706.
[18] L. A. Mendes, G. W. Dec, M. H. Picard, I. F. Palacios, J. Newell, and R. Davidoff, “Right ventricular dysfunction: An independent predictor of adverse outcome in patients with myocarditis,” Am. Heart J., vol. 128, no. 2, pp. 301–307, Aug. 1994, doi: 10.1016/0002-8703(94)90483-9.
[19] G. D. Aquaro et al., “Role of right ventricular involvement in acute myocarditis, assessed by cardiac magnetic resonance,” Int. J. Cardiol., vol. 271, pp. 359–365, Nov. 2018, doi: 10.1016/j.ijcard.2018.04.087.
[20] J. L. Cavalcante et al., “Diastolic function improvement is associated with favourable outcomes in patients with acute non-ischaemic cardiomyopathy: insights from the multicentre IMAC-2 trial,” Eur. Hear. J. – Cardiovasc. Imaging, vol. 17,no. 9, pp. 1027–1035, Sep. 2016, doi: 10.1093/ehjci/jev311.
[21] J. S. Ho, C. Sia, M. Y. Chan, W. Lin, and R. C. Wong, “Coronavirus-induced myocarditis: A meta-summary of cases,” Hear. Lung, vol. 49, no. 6, pp. 681–685, Nov. 2020, doi: 10.1016/j.hrtlng.2020.08.013.
[22] R. M. Inciardi et al., “Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19),” JAMA Cardiol., vol. 5, no. 7, p. 819, Jul. 2020, doi: 10.1001/jamacardio.2020.1096.
[23] B. Siripanthong et al., “Recognizing COVID-19–related myocarditis: The possible pathophysiology and proposed guideline for diagnosis and management,” Hear. Rhythm, vol. 17, no. 9, pp. 1463–71, 2020.
[24] B. B. Løgstrup, J. M. Nielsen, W. Y. Kim, and S. H. Poulsen, “Myocardial oedema in acutemyocarditis detected by echocardiographic 2Dmyocardial deformation analysis,” Eur. Heart J. Cardiovasc. Imaging, vol. 17, no. 9, pp. 1018–1026, 2016, doi: 10.1093/ehjci/jev302
[25] T. Caspar, M. Fichot, M. Ohana, S. El Ghannudi, O. Morel, and P. Ohlmann, “Late Detection of Left Ventricular Dysfunction Using Two-Dimensional and Three-Dimensional Speckle-Tracking Echocardiography in Patients with History of Nonsevere Acute Myocarditis,” J. Am. Soc. Echocardiogr., vol. 30, no. 8, pp. 756–762, Aug. 2017, doi: 10.1016/j.echo.2017.04.002.
[26] F. Escher et al., “New Echocardiographic Findings Correlate with Intramyocardial Inflammation in Endomyocardial Biopsies of Patients with Acute Myocarditis and Inflammatory Cardiomyopathy,” Mediators Inflamm., vol. 2013, pp. 1–9, 2013, doi: 10.1155/2013/875420.
[27] M. Awadalla et al., “Global Longitudinal Strain and Cardiac Events in Patients With Immune Checkpoint Inhibitor-Related Myocarditis,” J. Am. Coll. Cardiol., vol. 75, no. 5, pp. 467–478, 2020, doi: 10.1016/j.jacc.2019.11.049.
[28] Y. Li et al., “Prognostic Value of Right Ventricular Longitudinal Strain in Patients With COVID-19,” JACC Cardiovasc. Imaging, vol. 13, no. 11, pp. 2287–2299, Nov. 2020, doi: 10.1016/j.jcmg.2020.04.014.
[29] A. Wibowo et al., “Left and right ventricular longitudinal strains are associated with poor outcome in COVID-19: a systematic review and meta-analysis,” J. Intensive Care, vol. 9, no. 1, p. 9, Dec. 2021, doi: 10.1186/s40560-020-00519-3.
[30] O. F. Baycan et al., “Evaluation of biventricular function in patients with COVID-19 using speckle tracking echocardiography,” Int. J. Cardiovasc. Imaging, vol. 37, no. 1, pp. 135–144, Jan. 2021, doi: 10.1007/s10554-020-01968-5.
[31] H. Shmueli et al., “Left ventricular global longitudinal strain in identifying subclinical myocardial dysfunction among patients hospitalized with COVID-19,” IJC Hear. Vasc., vol. 32, p. 100719, Feb. 2021, doi: 10.1016/j.ijcha.2021.100719.
[32] P. Lurz et al., “Diagnostic Performance of CMR Imaging Compared With EMB in Patients With Suspected Myocarditis,” JACC Cardiovasc. Imaging, vol. 5, no. 5, pp. 513–524, May 2012, doi:
10.1016/j.jcmg.2011.11.022.
[33] V. M. Ferreira et al., “Cardiovascular Magnetic ResonaResonance in Nonischemic Myocardial Inflammation: Expert Recommendations,” J. Am. Coll. Cardiol., vol. 72, no. 24, pp. 3158–3176, 2018, doi: 10.1016/j.jacc.2018.09.072.
[34] H. Mahrholdt et al., “Presentation, Patterns of Myocardial Damage, and Clinical Course of Viral Myocarditis,” Circulation, vol. 114, no. 15, pp. 1581–1590, Oct. 2006, doi: 10.1161/CIRCULATIONAHA.105.606509.
[35] C. Unterberg-Buchwald et al., “Targeted endomyocardial biopsy guided by real-time cardiovascular magnetic resonance,” J. Cardiovasc. Magn. Reson., vol. 19, no. 1, p. 45, Dec. 2017, doi: 10.1186/s12968-017-0357-3.
[36] F. Schnell et al., “Subepicardial delayed gadolinium enhancement in asymptomatic athletes: let sleeping dogs lie?,” Br. J. Sports Med., vol. 50, no. 2, pp. 111–117, Jan. 2016, doi: 10.1136/bjsports-2014-094546.
[37] N. Mewton et al., “Myocardial biomarkers and delayed enhanced cardiac magnetic resonance relationship in clinically suspected myocarditis and insight on clinical outcome,” J. Cardiovasc. Med., vol. 16, no. 10, p. 696, Oct. 2015, doi: 10.2459/JCM.0000000000000024.
[38] J. Schumm et al., “Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis,” J. Cardiovasc. Magn. Reson., vol. 16, no. 1, p. 14, 2014, doi: 10.1186/1532-429X-16-14.
[39] G. Georgiopoulos et al., “Prognostic Impact of Late Gadolinium Enhancement by Cardiovascular Magnetic Resonance in Myocarditis,” Circ. Cardiovasc. Imaging, vol. 14, no. 1, Jan. 2021, doi: 10.1161/CIRCIMAGING.120.011492.
[40] E. Ammirati et al., “Quantitative changes in late gadolinium enhancement at cardiac magnetic
resonance in the early phase of acute myocarditis,” Int. J. Cardiol., vol. 231, pp. 216–221, Mar. 2017, doi: 10.1016/j.ijcard.2016.11.282.
[41] A. Pelliccia et al., “2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease,” Eur. Heart J., vol. 42, no. 1, pp. 17–96, Jan. 2021, doi: 10.1093/eurheartj/ehaa605.
[42] A. Pelliccia et al., “Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology (EAPC),” Eur. Heart J., vol. 40, no. 1, pp. 19–33, Jan. 2019, doi: 10.1093/eurheartj/ehy730.
[43] G. D. Aquaro et al., “Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis,” J. Am. Coll. Cardiol., vol. 74, no. 20, pp. 2439–2448, 2019, doi: 10.1016/j.jacc.2019.08.1061.
[44] V. Kytö, J. Sipilä, and P. Rautava, “Rate and patient features associated with recurrence of acute myocarditis,” Eur. J. Intern. Med., vol. 25, no. 10, pp. 946–950, Dec. 2014, doi: 10.1016/j.ejim.2014.11.001.
[45] F. Yang et al., “The prognostic value of late gadolinium enhancement in myocarditis and clinically suspected myocarditis: systematic review and meta-analysis,” Eur. Radiol., vol. 30, no. 5, pp. 2616–2626, May 2020, doi: 10.1007/s00330-019-06643-5.
[46] V. O. Puntmann et al., “Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19),” JAMA Cardiol., vol. 5, no. 11, p. 1265, Nov. 2020, doi: 10.1001/jamacardio.2020.3557.
[47] L. Huang et al., “Cardiac Involvement in Patients Recovered From COVID-2019 Identified Using Magnetic Resonance Imaging,” JACC Cardiovasc. Imaging, vol. 13, no. 11, pp. 2330–2339, Nov. 2020, doi: 10.1016/j.jcmg.2020.05.004
[48] H. Wang et al., “Cardiac involvement in COVID-19 patients: mid-term follow up by cardiovascular magnetic resonance,” J. Cardiovasc. Magn. Reson., vol. 23, no. 1, p. 14, Dec. 2021, doi: 10.1186/s12968-021-00710-x.
[49] M.-Y. Ng et al., “Patients Recovered From COVID-19 Show Ongoing Subclinical Myocarditis as Revealed by Cardiac Magnetic Resonance Imaging,” JACC Cardiovasc. Imaging, vol. 13, no. 11, pp. 2476–2478, Nov. 2020, doi: 10.1016/j.jcmg.2020.08.012.
[50] D. Brito et al., “High Prevalence of Pericardial Involvement in College Student Athletes Recovering From COVID-19,” JACC Cardiovasc. Imaging, vol. 14, no. 3, 2020, doi: 10.1016/j.jcmg.2020.10.023.
[51] J. Starekova et al., “Evaluation for Myocarditis in Competitive Student Athletes Recovering from Coronavirus Disease 2019 with Cardiac Magnetic Resonance Imaging,” JAMA Cardiol., pp. 1–6, 2021, doi: 10.1001/jamacardio.2020.7444.
[52] L. T. Cooper et al., “The Role of Endomyocardial Biopsy in the Management of Cardiovascular Disease,” Circulation, vol. 116, no. 19, pp. 2216–2233, Nov. 2007, doi: 10.1161/CIRCULATIONAHA.107.186093.
[53] M. Francone et al., “CMR Sensitivity Varies With Clinical Presentation and Extent of Cell Necrosis in Biopsy-Proven Acute Myocarditis,” JACC Cardiovasc. Imaging, vol. 7, no. 3, pp. 254–263, Mar. 2014, doi: 10.1016/j.jcmg.2013.10.011.
[54] A. Florian et al., “Diagnostic value of CMR in young patients with clinically suspected acute myocarditis is determined by cardiac enzymes,” Clin. Res. Cardiol., vol. 104, no. 2, pp. 154–163, Feb. 2015, doi: 10.1007/s00392-014-0770-7.
[55] J.-P. Collet et al., “2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation,” Eur. Heart J., Aug. 2020, doi: 10.1093/eurheartj/ehaa575.
[56] K. M. Takakuwa and E. J. Halpern, “Evaluation of a ‘Triple Rule-Out’ Coronary CT Angiography Protocol: Use of 64-Section CT in Low-to-Moderate Risk Emergency Department Patients Suspected of Having Acute Coronary Syndrome,” Radiology, vol. 248, no. 2, pp. 438–446, Aug. 2008, doi: 10.1148/radiol.2482072169.
[57] K. Axsom, F. Lin, J. W. Weinsaft, and J. K. Min, “Evaluation of myocarditis with delayed-enhancement computed tomography,” J. Cardiovasc. Comput. Tomogr., vol. 3, no. 6, pp. 409–411, Nov. 2009, doi: 10.1016/j.jcct.2009.09.003.
[58] G. Pontone et al., “‘Quadruple Rule-Out’ With Computed Tomography in a COVID-19 Patient With Equivocal Acute Coronary Syndrome Presentation,” JACC Cardiovasc. Imaging, vol. 13, no. 8, pp. 1854–1856, Aug. 2020, doi: 10.1016/j.jcmg.2020.04.012.
[59] C. Bouleti et al., “Usefulness of Late Iodine Enhancement on Spectral CT in Acute Myocarditis,” JACC Cardiovasc. Imaging, vol. 10, no. 7, pp. 826–827, Jul. 2017, doi: 10.1016/j.jcmg.2016.09.013.
[60] K. Fischer et al., “Feature Tracking Myocardial Strain Incrementally Improves Prognostication in Myocarditis Beyond Traditional CMR Imaging Features,” JACC Cardiovasc. Imaging, vol. 13, no. 9, pp. 1891–1901, 2020, doi: 10.1016/j.jcmg.2020.04.025.
[61] F. Nensa et al., “Hybrid cardiac imaging using PET/MRI: a joint position statement by the European Society of Cardiovascular Radiology (ESCR) and the European Association of Nuclear Medicine (EANM),” Eur. Radiol., vol. 28, no. 10, pp. 4086–4101, 2018, doi: 10.1007/s00330-017-5008-4.
[62] Y. Tu, Y. Sun, Y. Fan, Z. Cheng, and B. Yu, “Multimodality Molecular Imaging of Cardiovascular Disease Based on Nanoprobes,” Cell. Physiol. Biochem., vol. 48, no. 4, pp. 1401–1415, 2018, doi: 10.1159/000492251.
[63] D. C. Steinl et al., “Noninvasive contrast-enhanced ultrasound molecular imaging detects myocardial inflammatory response in autoimmune myocarditis,” Circ. Cardiovasc. Imaging, vol. 9, no. 8, pp. 1–8, 2016, doi: 10.1161/CIRCIMAGING.116.004720.
Ερωτήσεις πολλαπλής επιλογής
Η πολυσυστηματική φλεγμονώδης αντίδραση στα πλαίσια της νόσου COVID-19, χαρακτιρήζεται από:
1. Προσβολή μυοκαρδίου, αλλά όχι του γαστρεντερικού συστήματος.
2. Εμφανίζεται πιο συχνά σε μεσήλικες γυναίκες με συνοδά νοσήματα.
3. Μπορεί να εμφανισθεί σε ασθενείς με αποδραμούσα λοίμωξη από SARS-CoV-2.
4. Εμφανίζεται με έντονα συμτώματα από το αναπνευστικό σύστημα και υποξία.
5. Η RT-PCR για SARS-CoV-2 κατά την προσέλευση πρέπει να είναι θετική.
Υπερηχοκαρδιογραφία στην μυοκαρδίτιδα από COVID-19 – Τι ισχύει:
1. Χρησιμοποιείται μόνο για την διάγνωση της νόσου.
2. Η φυσιολογική υπερηχοκαρδιογραφική μελέτη αποκλείει την μυοκαρδίτιδα.
3. Η μειωμένη μυοκαρδιακή παραμόρφωση της δεξιάς κοιλίας είναι σημάδι κακής πρόγνωσης, μόνο αν συνδιάζεται και με δυσλειτουργία της αριστερής κοιλίας.
4. Η υπερηχογραφία παραμόρφωσης έχει μειωμένη αξία σε ασθενείς με ιστορικό μυοκρδιοπάθειας.
5. Η υπερηχογραφία παραμόρφωσης έχει μειωμένη αξία σε συμπτωματικούς ασθενείς με διατηρημένο κλάσμα εξώθησης αριστερής κοιλίας.
Η μαγνητική και η αξονική τομογραφία καρδιάς στην μυοκαρδίτιδα –Τι ισχύει:
1. Η μαγνητική τομογραφία χρησιμοποιείται για διαφορική διάγνωση μυοκαρδίτιδας από έμφραγμα μυοκαρδίου και από Takotsubo μυοκαρδιοπάθεια.
2. Η μαγνητική τομογραφία δεν χρησιμοποιείται για την παρακολούθηση ασθενών με μυοκαρδίτιδα.
3. Η μαγνητική τομογραφία με την Τ2 ακολουθεία δεν κατάφερε να αναδείξει υποκλινική φλεγμονή του μυοκαρδίου στα πλαίσια της COVID-19.
4. Η αξονική τομογραφία δεν είναι επαρκής για τον αποκλεισμό αθηρωμάτωσης σε ασθενείς χαμηλού-μετρίου κινδύνου για στεφανιαία νόσο.
5. Η αξονική τομογραφία χρησιμοποιείται αποκλειστικά για διάγνωση στεφανιαίας νόσου.
